Oct 27, 19 · mol/Lは滴定による含量分析でよく使います。 「滴定による含量分析」について説明すると、 既知濃度の滴定液と未知濃度の試料を反応させ、 反応終了までに加えた滴定液の量から、サンプルの濃度を算出する。 という分析のことです。ビュレットの0.01M-EDTA標準溶液で滴定を行う。 溶液の色が赤紫色から青色になったところを終点とする。 6) 1~5を3回繰り返し、滴定平均値を求める。 7) Ca硬度を計算し求める。 8) Mg硬度を計算し求める。Edta滴定によるアルミニウムの定量について1 マンガンの共存における アルミニウムの逆滴定法 一土壌分析への応用一 新名謹之助的 1序言 土壌・土壌粘土または土壌抽出液中のアルミニウムの直接的*定量法としては,筆者はすでに前報5)6)

17 号 可搬型滴定装置 Astamuse
キレート滴定 計算問題
キレート滴定 計算問題-Nov 05, · 本記事はedtaの性質とキレート滴定について、わかりやすくまとめた記事です。この記事を読んで理解すると、edtaなどのキレート試薬の特徴を押さえることができます。また、キレート滴定の原理について、理解を深めることができます。(分析化学I・3枚中の2枚目) 問題2 キレート滴定について、設問に答えよ。 問 A Cu2 を001 mol L–1 含み、酢酸-酢酸ナトリウム緩衝液でpH 5に調整 してある試料溶液100 mLに対して、001 mol L–1 エチレンジアミン四 酢酸(EDTA;



水の硬度 株式会社ユニケミー ユニラボ
May 27, 10 · キレート滴定の計算についてです。ミネラルウォーターを001m edta標準溶液で滴定しました。実験の結果から、カルシウムイオンとマグネシウムイオンの濃度の総和を求めよ。とのことなのですが、全くわかりません。解法を教えてください。Phの計算(弱酸・弱塩基溶液) phの計算(多塩基酸、両性物質) 錯体化学 重量分析、定量分析 光学分析・構造解析・分離分析 紫外可視吸収スペクトル 赤外吸収(ir)・ラマンスペクトル 核磁気共鳴(nmr)の基礎 ベンゼン環の核磁気共鳴:nmr分析実は,イオンクロマトグラフを硬度測定に使うには,幾つか問題があるんだよ。 Ca=とMg=,炭酸カルシウムの分子量はCaCO 3 =だから,下の式を使えば簡単に計算 硬度は滴定で測ってたんだ。キレート滴定って奴だけど,正確に測るためには
金属イオンの色、合金、キレート滴定 2はキレート滴定についての分析化学問題。リード文をよく読めば解答可能だが、edtaについては初見の受験生が多く、難解な問題になっており差がつく。 マーク式:計算/語句/空所補充 記述式:単答/空所補充;17種の水を試料とし、キレート滴定法を行い、硬度とCa2、Mg2の量を決定した。その結果を表1に示す。 表1 様々な水の分析結果 ★考察★ A~Cの結果から、やはり硬度には大きな差があることが分H4Y)溶液を(1)95 mL、(2)100 mL、(3)105 mL
Aug 05, 17 · プロ講師解説このページでは『中和滴定の一種である逆滴定(例題・計算問題の解き方・原理など)』について解説しています。 解説は高校化学・化学基礎を扱うウェブメディア『化学のグルメ』を通じて6年間大学受験に携わるプロの化学講師が執筆します。演習 (p71)/問題 34 難 <キレート滴定> EDTA液によるMgCl 2 の滴定(滴定時pMg) 演習(p86)/問題 15 EDTA標準液の標定(直接法) 演習 (p)/問題 8 EDTA標準液による亜鉛の滴定 CBT (p143)/問題 612 キレート滴定の金属指示薬 CBT (p144)/問題 613まで滴定する(ブロモクレゾールグリン試洷 2滴)。 アスピリンの定量 アスピリンの定量は,逆滴定に用いた硫酸について計算する。そのため,水酸化ナトリ ウムの量は計算には必要なく,操作中に溶け込んだ二酸化炭素は計算から除外される。




非水滴定の指示薬と標準液のゴロ 覚え方 薬学ゴロ 薬学部はゴロでイチコロ



Blogjpmbahetwfl 無料ダウンロード キレート滴定 計算 亜鉛 キレート滴定 計算 亜鉛
錯体・キレート 錯体平衡の計算問題を解いてみよう演習問題 ・錯体・キレート平衡の計算問題 その1 というテーマで解説していきます。 錯体・キレート平衡の計算問題 その1演習問題 それでは、頻出の錯体解離平衡に関する演習問題を解いてみMay 19, · すると、 滴定によって未知の濃度などを求めることが不可能になってしまいます 。 このような場合も存在するので、頭に入れておきましょう。 中和滴定の計算問題 では実際に計算問題の解き方と練習問題を見ていきましょう。EDTA と金属キレートのK f 値→p18, 表12 <例:EDTA とMg2> K f = 49×108 log K f = 8 log 49 = 869 ML n M Ln 8 キレート滴定 多座配位子EDTA(標準液)が 金属イオン(Zn 2, Mg 2, Ca , Al3, Cu 等)と 水溶液中で安定な可溶性のキレート化合物を生成する ことを利用した




17 号 可搬型滴定装置 Astamuse



逆滴定 例題 計算問題の解き方 原理など 化学のグルメ
工学基礎化学実験 比色分析 ≪真ちゅう釘中の銅の定量≫ 実験目的 硫酸銅水溶液中の銅イオンをキレート滴定によって求める。Cu2イオンにアンモニアを加えると深青色のアンミン銅錯イオンが生成する。この発色を利用して,濃度が既知のアンミン銅錯イオンの水溶液により,分光光度計をJun 12, 19 · キレート滴定の問題です。 0010Mの銅(Ⅱ)イオンと0010MのEDTAを含むpH400の溶液において、フリーの銅(Ⅱ)イオンは銅全濃度の何パーセントを占めるか。ただし、CuY2の生成定数は63×10^18であり、pH400におけるα4=33×10^(9)とする。これを解いてください。 pH=400では主に次の反応が起こりCuY^2キレート滴定の諸問題と, 石灰石, ドロマイト露頭における化学成分の変動について 藤貫 正 , 藤谷 吉三 著者情報 藤貫 正 通商産業省地質調査所化学課 藤谷 吉三 通商産業省地質調査所化学課 ジャーナル フリー 1966 年 1966 巻 号 p



化学 標準 理論化学 担当 犬塚 Juken7 Note




ミネラル サプリ キレート 滴定
Aug 05, 17 · 二段滴定(原理・例題・計算問題の解き方など) プロ講師解説このページでは『 中和滴定 の一種である二段滴定(仕組みや入試頻出の計算問題の解法など)』について解説しています。 解説は高校化学・化学基礎を扱うウェブメディア『化学のJul 01, 12 · 薬学まとめました。このサイトは薬学の重要事項をコアカリキュラムに準拠したかたちでまとめています。大学の授業や薬剤師国家試験の対策にぜひ役立ててください。錯形成平衡とキレート滴定(2) 8 キレート滴定の原理を理解し,金属イオン濃度に関する計算ができる. 14週 酸化還元平衡と酸化還元滴定(1) 9 ネルンスト式を用いて平衡電位に関する計算ができる. 15週 酸化還元平衡と酸化還元滴定(2) 10




1999 1017号 滴定制御方法 Astamuse




Images Of キレート滴定 Japaneseclass Jp
キレート滴定法の原理で,こ の方法により,2価 以上の 金属イオンのほとんど全部がedtaに よって滴定でき るようになりました それで問題はどのような方法で遊離金属イオンのなくMar 14, 21 · ミネラル サプリ キレート 滴定 キレート滴定 計算 亜鉛 キレート滴定 計算 亜鉛キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。問題28 キレート滴定法による銅と亜鉛の定量 合金は、日々の生活の様々な場面で使用されている。とりわけ、その特性(たとえ ば伝導性,機械的特性あるいは耐食性など)により、合金は航空学,建




Dviout 気体と溶 Pdf 無料ダウンロード




17 号 可搬型滴定装置 Astamuse
示薬としてedta溶液で滴定し,edta溶液の正確な濃度を決定する。 4.キレート滴定によるca2+とmg2+の定量 試料水にph 10緩衝液を加え,edta溶液とebt指示薬を用いてキレート滴定を 行い,試料水に含まれるca2+とmg2+の合計量を定量する。キレート滴定 エチレンジアミン四酢酸(edta、h 4 yと略記)は、水溶液中で金属イオンと反応し、 非常に安定な金属キレート化合物を作る。 キレート滴定は、そのことを利用した容量分析法である。キレート生成反応は、 である。キレート生成平衡 キレート滴定に汎用されるキレート試薬;EDTA(六座配位子) ethylenediaminetetraacetic acid エチレンジアミン四酢酸 >NCH 2CH 2N< CH 2 COOH HOOCH C CH 2 COOH HOOCH C EDTAと金属との反応比は1:1 試薬としては 2Na塩を入手




Images Of 中和滴定 Japaneseclass Jp



錯イオンとは 命名法や構造 配位子などの意味 覚え方まで詳しく解説
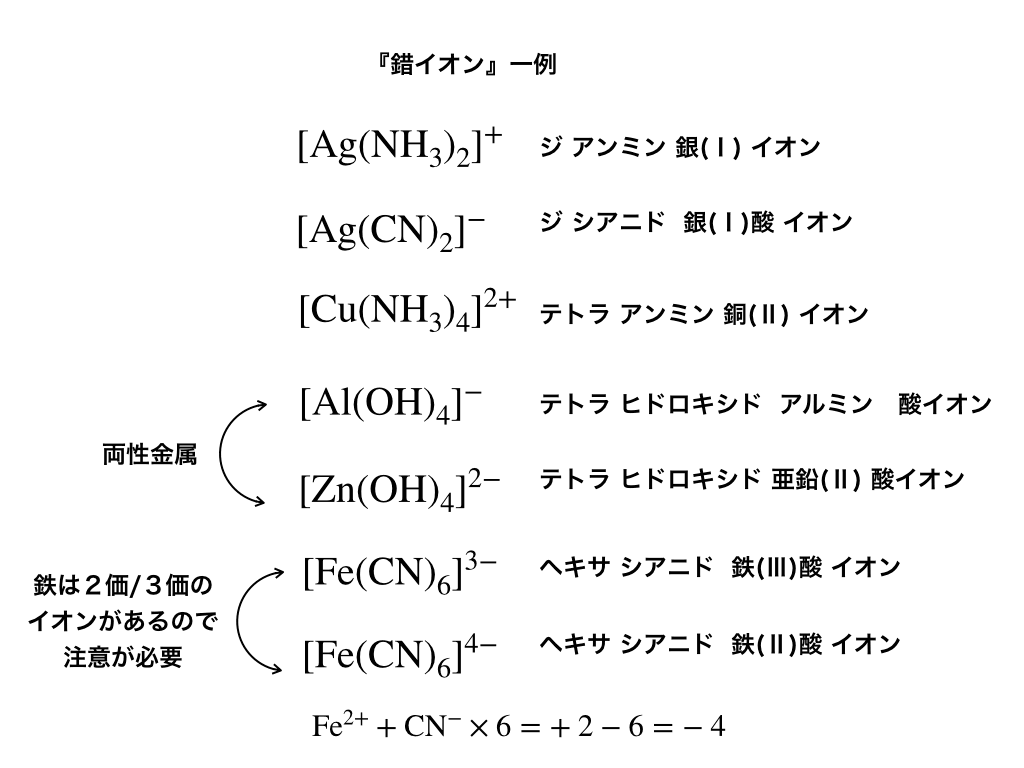
(5) 滴定・終点操作 (ア) 手際よく滴定操作ができている。 (イ) 終点の判断が適切である。 3 完成度・結果について 1 報告書 (1) 反応式・計算式など必要なものが記入されている。 (2) 反応式に基づいた計算が正しくされている。 (3) 誤差を考慮している。2.キレート効果 (text p) 二座以上の配位子が金属イオンを挟むような形で錯体を形成するとき,中心金属と配位原子を含む環 ができる.このような錯体をキレート(金属キレートあるいはキレート化合物)とよぶ.第105回 実践問題③ ユーチューブ動画テキスト 薬剤師国家試験の過去問の解説をはじめ、薬剤師国家試験を勉強するに当たって必要な情報を提供しています。




Dviout 酸と塩 Pdf 無料ダウンロード



逆滴定 例題 計算問題の解き方 原理など 化学のグルメ
①滴定が定量的であるとは、誤差が01%以内であるとする。 ②滴定誤差が01%以内とは、生成したキレートの解離が01%以内のことである。 Ex 001mol/L のMn+溶液v mLを001mol/LのY4−標準液で滴定するとき、当量点では、 Mn+]=[Y4−]=001×実験問題2 キレート滴定とヨウ素還元滴定による 金属イオンの定量 (18 5 27, IChO50代表生徒強化訓練合宿@長崎大学) キレート滴定(錯滴定)とヨウ素還元滴定は,溶液中の金属イオンの定量方法として,代表的 な方法である。亜鉛イオン(Zn2)は、キレート滴定によって容易に定量できます。亜鉛のEDTA による滴定が できるpH 領域(pH45~10)は広くかつEDTA に対する安定度定数も大きく、鋭敏に変色する 指示薬も多



逆滴定 例題 計算問題の解き方 原理など 化学のグルメ




国際化学オリンピックに挑戦 5 実験 国際化学オリンピックobog会 本 通販 Amazon
3.edtaによるキレート滴定 競技では,edtaによるキレート滴定の原理やebt指示薬やnn指示薬を用いてca2+ やmg2+ を定量する具体的な方法を問題文の1,2ページに記載し,初学者にも充分理解で きるように配慮した。次に実験操作の手順を簡潔に示す。44 キレート滴定の条件とph 45 edtaおよびntaによるキレート滴定の条件 46 金属指示薬とは何か 47 キレート滴定の種類 48 錯生成反応を支配する因子 演習問題 問題解答 5.酸化還元反応と酸化還元滴定 51 電極電位とネルンスト式の理解キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。




1997 号 金属イオンのための酵素増幅競合アッセイ及びサンドイッチキレート化アッセイ Astamuse




Blogjpmbahetwfl 無料ダウンロード キレート滴定 計算 亜鉛 キレート滴定 計算 亜鉛
キレート滴定の計算方法 1 試薬の体積と初濃度 塩化アンモニウムNH 4 Cl-アンモニア水NH 3 系のpH緩衝液により,常にpH=10一定であると仮定する.計算を簡単化するために,カルシウムイオンCa 2 やマグネシウムイオンMg 2 と指示薬のエリオクロムブラックT(EBT)の錯体形成反応(化学平キレート 滴定法で土壌中のカルシウム濃度が簡便に測定する ことが確認できたので,今後サンプル数を増やして データを取得していきたい。 3.結論 ①本実験では二酸化炭素を添加した水への炭酸カル シウムの溶解度が大きくなることがキレート滴定に水の硬度計算 こんなサイトがあるとは知りませんでした。 ありがとうございます。 馬鹿なことをお伺いしますが、ペットボトルには100mL中の成分表示がされています。 これをそのまま入力すればよいのですよね。 入力欄は1L = 1000mL辺りの含有量になり




Chemgrowing Vol 10 Pdf Free Download




送料無料 Sa 319b Cx 5 Kf2p Diesel Blitz ブリッツ Lm エアフィルター サスパワー 開催中 Lmd パワーエアフィルター 純正交換タイプ
May 14, 21 · 大学の水道水を使ってキレート滴定を行いました。Ca2とMg2のモル濃度の合計量は940×10^4mol/L Mg2とCa2の合計滴下量平均値は749ml Ca2のモル濃度624×10^4mol/L Ca2の滴下量平均値497ml Mg2のモル濃度は316×10^4mol/L全硬 度 = EDTAの滴定量 × 1000/試料100ml (硬度は1リットル中の量として表すため1000をかける) 解説 この実験では金属イオンにEDTAを加え、金属キレート化合物を生成させ、それをEBTのような金属指示薬で滴定しています。
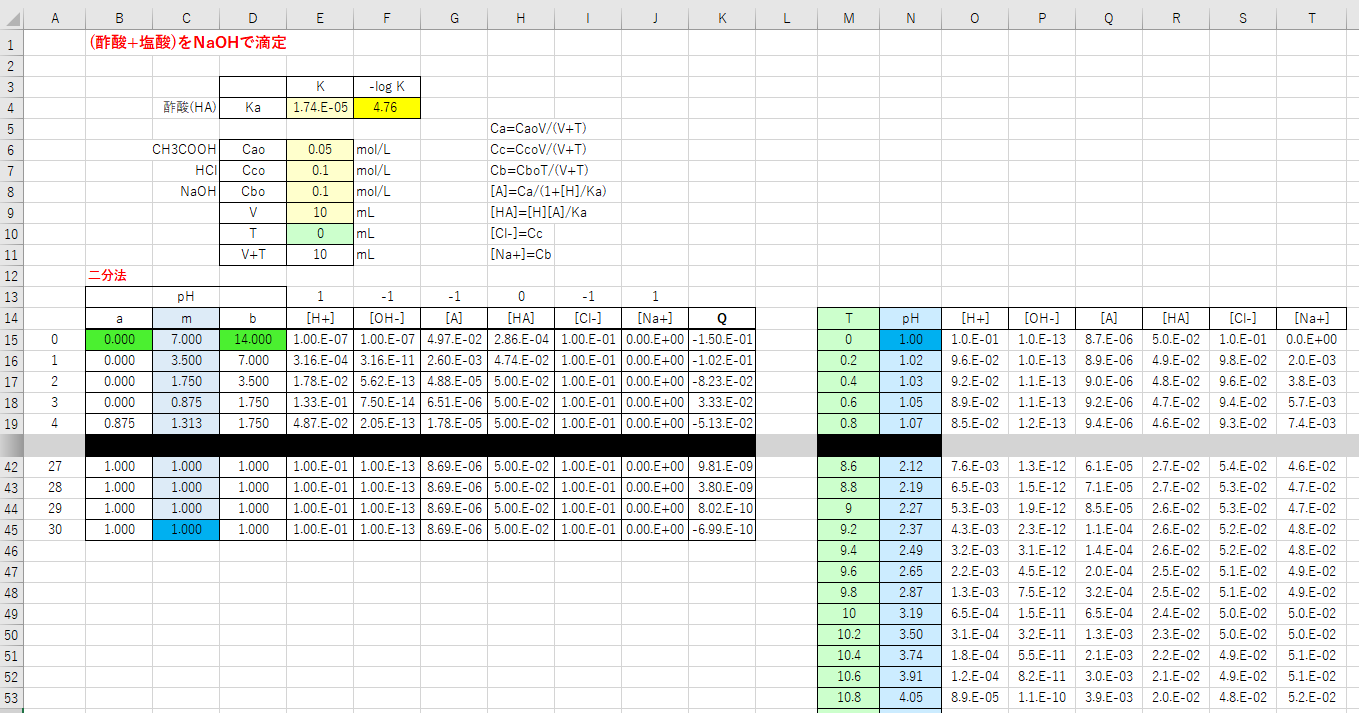



滴定曲線 滴定曲線 溶解度などーエクセルを用いて




ビジネスシューズ 軽量ウォーキング 紳士靴 黒 軽量 スリッポン ローファー ベーシック メッシュライニング スニーカー通勤 革靴 ヒモなし スニーカー ビジネス 軽い Ky9706 セットアップ




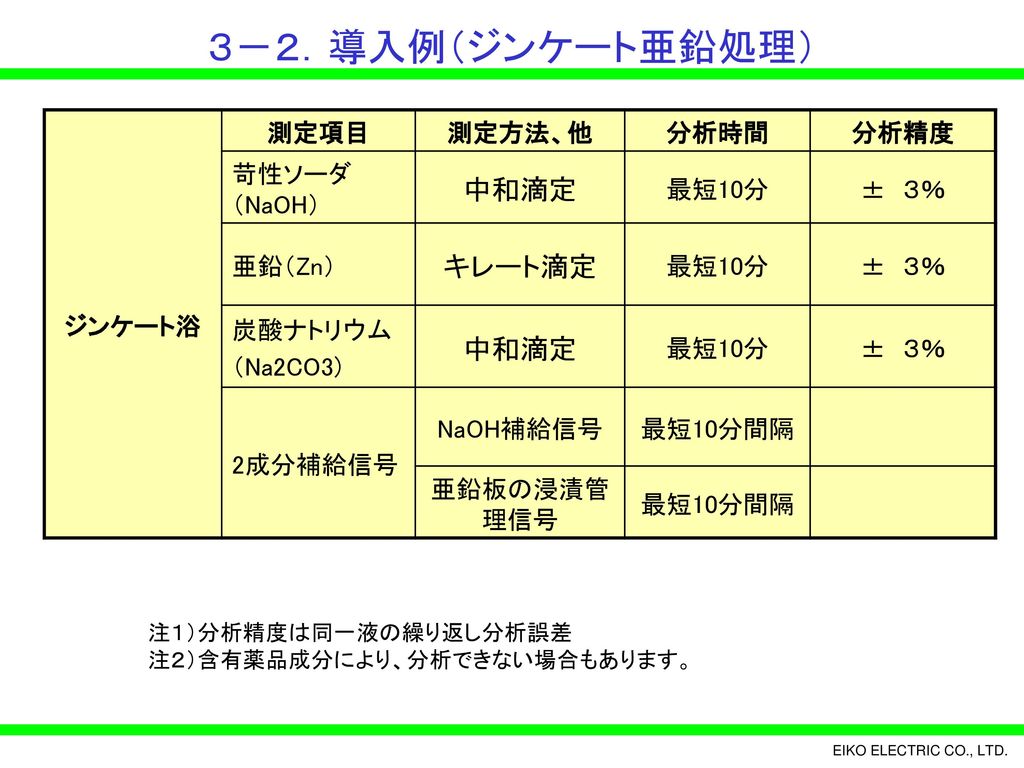
薬液処理浴自動管理装置 めっき管理主任シリーズ のご紹介 Ppt Download




浸透圧 Mosm L の計算 Youtube
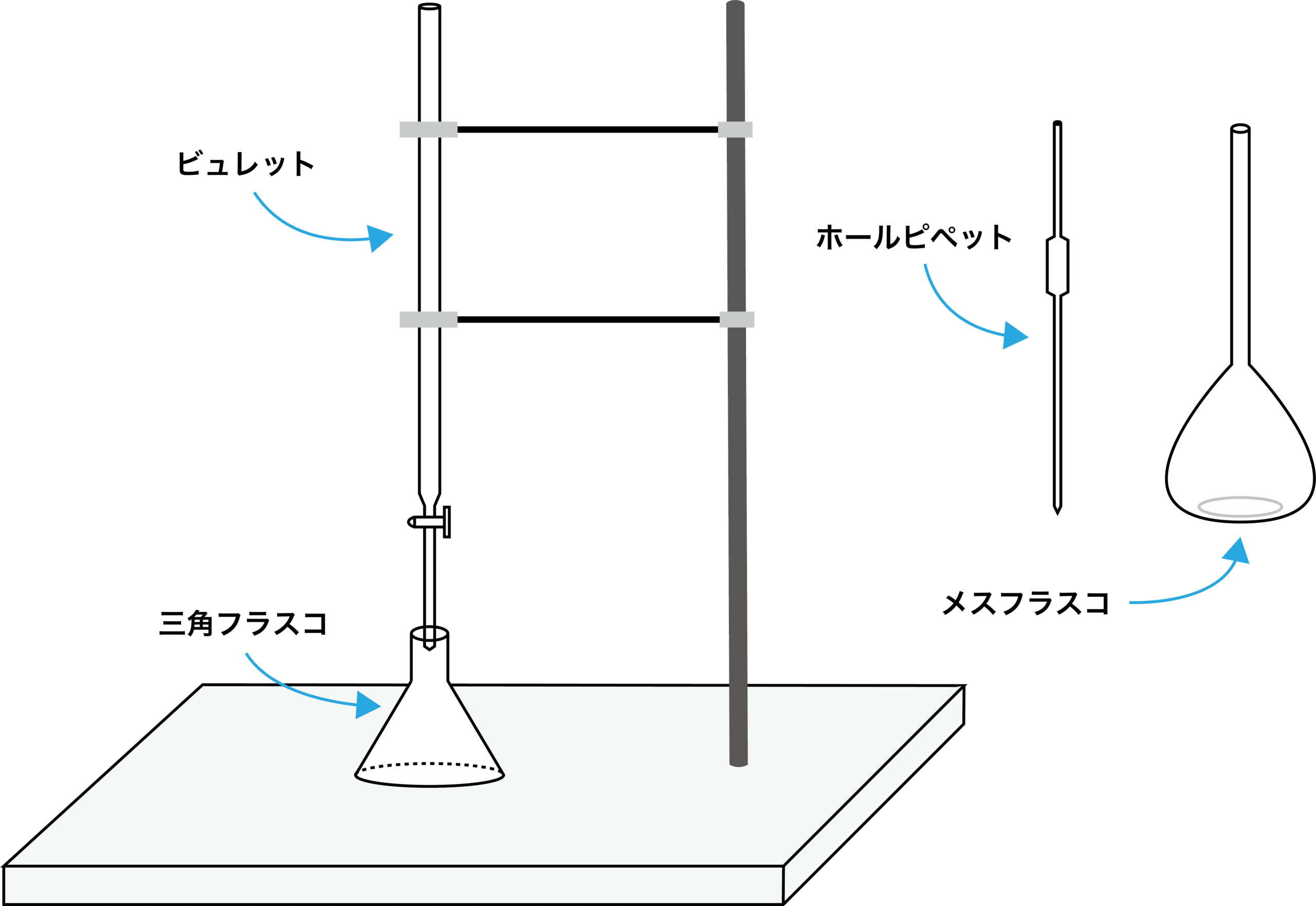



共洗い 中和滴定でビュレットとホールピペットを共洗いする理由や器具の覚え方など 化学のグルメ




1997 号 金属イオンのための酵素増幅競合アッセイ及びサンドイッチキレート化アッセイ Astamuse




目 次 Pdf Free Download




Blogjpmbahetwfl 無料ダウンロード キレート滴定 計算 亜鉛 キレート滴定 計算 亜鉛




Microsoft Word 0 実験書 表紙 Doc Pdf Free Download




Dviout 酸と塩 Pdf 無料ダウンロード



水の硬度 株式会社ユニケミー ユニラボ




17 号 可搬型滴定装置 Astamuse
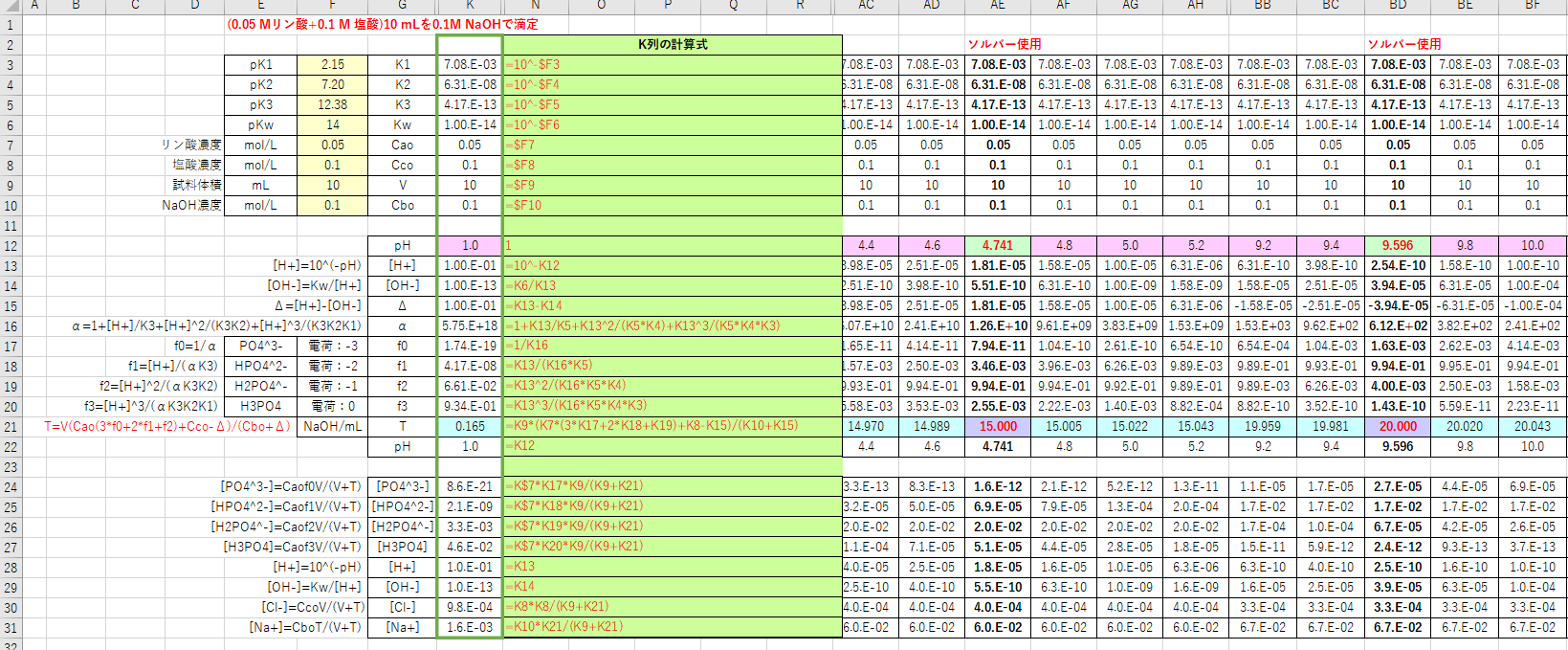



滴定曲線 滴定曲線 溶解度などーエクセルを用いて




化学基礎 番外編1 キレート Youtube




滴定の解説 イプロスモノシリ モノシリ 製造業技術用語集




Blogjpmbahetwfl 無料ダウンロード キレート滴定 計算 亜鉛 キレート滴定 計算 亜鉛




Images Of キレート滴定 Japaneseclass Jp




キレート滴定法の意味 用法を知る Astamuse
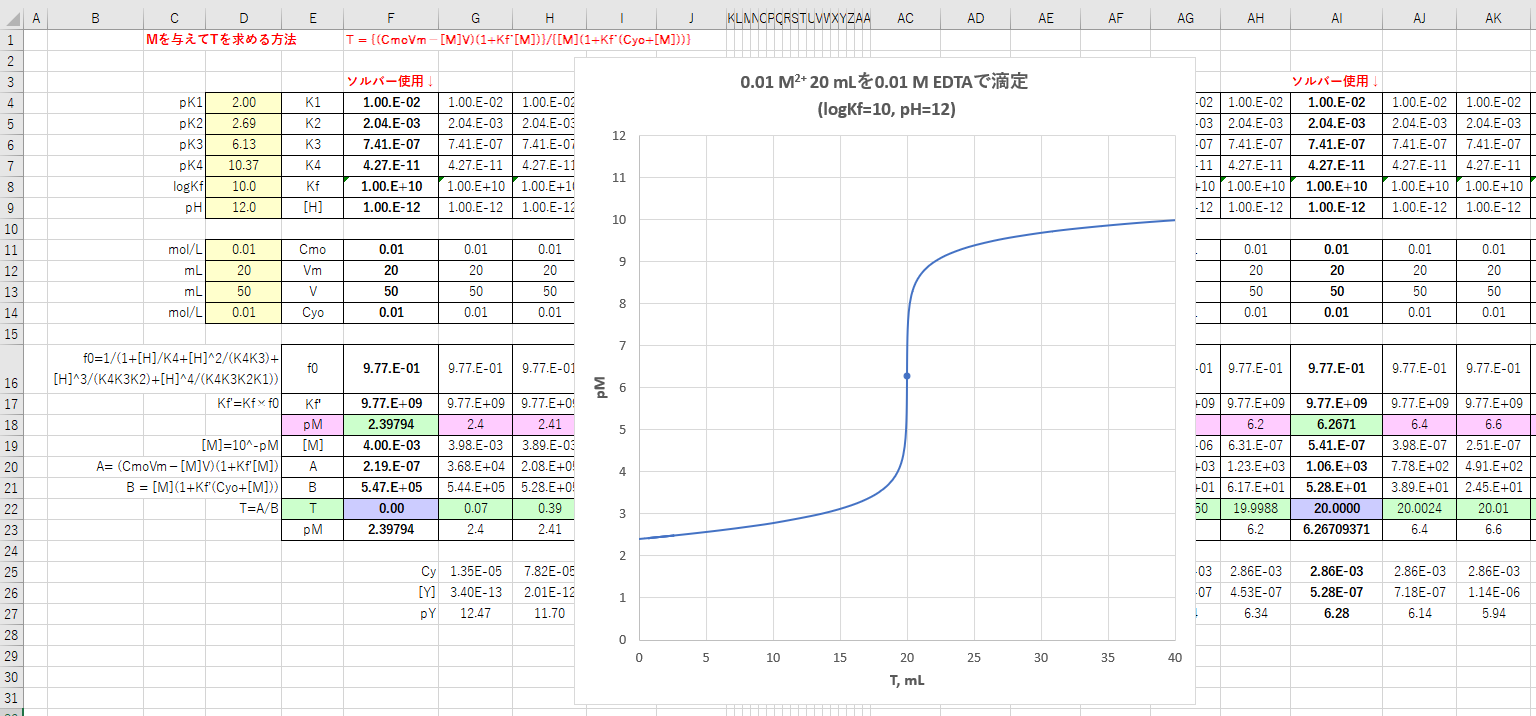



滴定曲線 滴定曲線 溶解度などーエクセルを用いて




送料無料 長袖 フーディー ラグランスリーブ プルオーバー スウェット 裏毛 ブランド カジュアル 国産 冬 秋 日本製 Xl ラグランプルオーバーパーカー ミッドエアー Iito ベア裏毛 イート 美品 メンズ




高麗人参 30日 Dhc Dhc 朝鮮人参 サポニン サプリメント 人気 ランキング サプリ 即納 寝起き 美容 ファクトリーアウトレット ビタミンe 女性 男性 和漢植物 食事 仕事 送料無料 健康 ウコギ




Images Of キレート滴定 Japaneseclass Jp



0 件のコメント:
コメントを投稿